Buhar Basıncı Kaynama Noktası Arasındaki Ilişki
Bu yazıda Kaynama Noktası ve Buhar Basıncı arasındaki ilişkiyi tartışacağız.
Bir maddenin kaynama noktası sistemin basıncına, bir maddenin buhar basıncı ise sistemin sıcaklığına bağlıdır.
İlkokul günlerimizde fen ders kitabımız bize suyun 100 santigrat derecede kaynadığını öğretti. Daha üst sınıflara çıktıkça, deniz seviyesinde suyun atmosfer basıncında 100 santigrat derecede kaynadığını ve yükseldikçe kaynama noktasının düştüğünü öğrendik.
Bu öncelikle şunları açıklar: kaynama noktasının basınçla bağımlılığı olgusu.
Peki, kaynayan nedir? Fiziksel olarak sıvının buhara dönüşmesi olgusudur. Kaynamayı daha geek bir şekilde anlamak için, diğer terimi, yani buhar basıncını anlamalıyız. Buhar basıncı, herhangi bir sıvının belirli bir sıcaklıkta yüzeyi üzerine uyguladığı basınçtır.
Bu buhar basıncı sıvının sıcaklığı arttıkça artar. Sistemin buhar basıncı ile toplam basıncının aynı olduğu sıcaklığa denir. Kaynama Noktası bir maddenin.
Buhar Basıncı ile Kaynama Noktası Aynı mı?
Hayır, buhar basıncı ve kaynama noktası aynı değildir, ancak buhar basıncı bir sıvıya özgüdür ve aynı sıcaklıkla değişir. Aynı kaynama noktası nedeniyle bir sıvıya da özgüdür.
Farklı sıvılar, belirli bir sıcaklıkta farklı buhar basınçları uygular. Bir sıvının uyguladığı buhar basıncı, sıvıyı oluşturan moleküller arasında mevcut olan moleküller arası kuvvetlere bağlıdır.
Belirli bir sıcaklıkta, bir sıvının molekülleri arasındaki daha düşük moleküller arası kuvvetler için, sıvı tarafından uygulanan daha yüksek buhar basıncı elde edilir. EĞER belirli bir sıcaklıktaki buhar basıncı daha fazlaysa, sıvının kaynama noktası daha az olacaktır. Dolayısıyla, buhar basıncı ve kaynama noktası aynı olmasa da birbirleriyle bağlantılı oldukları ve bir sıvıya özgü oldukları sonucuna varılabilir.
Kaynama Noktası ve Buhar Basıncı Nedir?
Kaynama, sıvının buhar basıncı, sistem basıncı olarak da adlandırılan, üstündeki sıvının basıncına ulaştığında, sıvının şiddetli buharlaşması ile karakterize edilir.
Atmosferik koşullar altında kaynama noktasına normal kaynama noktası da denir. Kaynama başladıktan sonra, sıvı yüzeyinin üzerindeki basınç tüm sıvı kaynayana kadar sabit tutulursa sıcaklık sabit kalır.
Aşağıdaki resimde görüldüğü gibi, bir kapta bulunan sıvıdaki moleküller sürekli hareket halindedir. Moleküllerin bir kısmı sıvı yüzeyinden atmosfere kaçar ve bir kısmı atmosferden sıvıya geri döner.
Belirli bir sıcaklıkta, yığın sıvıdan kaçan moleküller ile yığın sıvıya geri çarpan moleküller arasında denge oluşur.
Belirli bir sıcaklıkta buhar boşluğunda kalan moleküllerin miktarı sıvının moleküller arası kuvvetlerine bağlıdır. Sıvı üzerinde buhar boşluğunda kalan bu moleküller sıvının buhar basıncını oluşturur.
Buhar Basıncının Kaynama Noktasına Etkisi
Buhar basıncı, bir sıvının kaynama noktası ile ters orantılıdır.
Buhar basıncı düştükçe, sistem basıncına ulaşmak için gerekli miktarda çözücüyü buharlaştırmak için daha fazla enerji gerektiğinden kaynama noktası yükselir. Belirli bir sıvı için, buhar basıncı, sıvı-buhar ara yüzeyindeki yığın sıvıdan kaçmak için çözücü molekülleri için mevcut olan boşluğa bağlıdır.
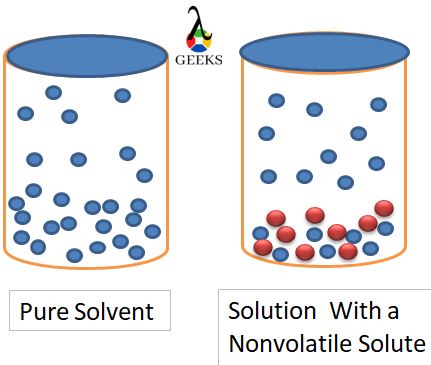
Bir şeker çözeltisinde olduğu gibi sıvı içinde daha fazla katı çözülürse, çözücü moleküllerinin buhar boşluğuna kaçması için buhar-sıvı ara yüzeyinde daha az boşluk olur ve bu nedenle daha düşük buhar basıncı uygulanır.
Bu, daha yüksek normal kaynama noktasına yol açan saf çözücü ile karşılaştırıldığında aynı buhar basıncını elde etmek için daha yüksek enerji gereksinimine yol açar.
Kaynama Noktası ve Basınç İlişkisi
Daha yüksek sistem basıncı, daha yüksek kaynama noktası ve daha düşük sistem basıncı, daha düşük kaynama noktası, yani sistem ile sonuçlanır basınç kaynama noktası ile doğru orantılıdır.
Sistem basıncı daha yüksekse, sistem basıncına eşdeğer buhar basıncı oluşturmak için daha fazla enerji gerekecektir. Benzer şekilde, Sistem basıncı daha düşükse, buhar basıncı gereksinimi daha düşük olduğundan kaynama noktası daha düşük sıcaklıkta elde edilir.
Bu, suyun kaynama noktasının kot farkıyla değişmesiyle de açıklanabilir. Aşağıda gösterildiği gibi, su 100 atmosfer basınçta deniz seviyesinde 1°C'de kaynar.
Ancak bir tepeye çıktıkça atmosfer basıncı düşer ve su daha düşük sıcaklıkta kaynar. Aynı nedenle, açık bir kapta pirinç pişiren bir kişi, pişirme işlemi daha düşük sıcaklıklarda gerçekleştiği için pişirmek için daha fazla zamana ihtiyaç duyacaktır.
Öte yandan, düdüklü tencerede olduğu gibi basınçlı bir sistemde pişirme yapılırsa, kaynama daha yüksek sıcaklıkta gerçekleştiği için pişirme çok daha hızlı olur.
Kaynama Noktası ve Buhar Basıncı Neden Ters İlişkilidir?
Kaynama noktası ve buhar basıncı ters orantılıdır, çünkü yeterli sıvıyı gaz fazına buharlaştırmak ve sistem basıncına (kap atmosfere açıksa atmosferik basınç) eşdeğer bir buhar basıncı üretmek ve böylece kaynama noktasına ulaşmak için daha yüksek enerji gerekecektir.
Moleküller arası kuvvetleri daha yüksek olan sıvılar için buhar basıncı daha düşük olacaktır ve bunun tersi de geçerlidir.Bu nedenle, belirli bir sıcaklıkta daha düşük buhar basıncına sahip sıvının üstesinden gelmek için daha yüksek enerji gereksinimi gerekir.Moleküller arası kuvvetler sıvı haldedir ve daha yüksek buhar basıncına sahip sıvılara kıyasla buhara kaçar.
Benzer şekilde, bir çözücünün buhar basıncı, içine çözünen maddeler eklenerek düşürülürse, böylece buhar-sıvı ara yüzeyinde açıkta kalan yüzey alanı küçülürse, buharlaşmak için gereken enerji artar. Bu, bu şekilde oluşan çözeltinin kaynama noktasının yükselmesine yol açar.
Buhar Basıncını Ne Etkiler?
Belirli bir sıvı için buhar basıncı, sıcaklığına bağlıdır.
Farklı sıvıların buhar basıncı belirli bir sıcaklık için farklıdır. Birkaç sıvının buhar basıncı 25°C'de aşağıda gösterilmiştir.
| madde | 25'te buhar basıncıoC |
| dietil eter | 70 kpa |
| brom | 30 kpa |
| Su | 3 kpa |
Farklı maddeler için buhar basıncı farklıdır çünkü bu sıvılar farklı moleküller arası kuvvetlere sahiptir. Genel olarak, daha düşük moleküler boyuta ve dolayısıyla daha düşük moleküller arası kuvvetlere sahip olacak daha düşük yoğunluklu sıvılar, belirli bir sıcaklıkta daha yüksek buhar basıncına sahiptir.
Bir sistemde sıcaklık arttırılırsa, moleküllerin kinetik enerjisi artar, bunun sonucunda moleküller hızlı hareket eder ve daha fazla sayıda molekül buhar formuna kaçar. Bu şekilde artan sıcaklıkla buhar basıncı artar.
Ancak buhar basıncı, sıvının tutulduğu kabın şekli veya boyutundan etkilenmez. Düşman örneği, dikey bir sıvı damar veya yatay bir kap aynı buhar basıncına sahip olacaktır.

Buhar Basıncının Artmasına Neden Olan Nedir?
Sıcaklık arttıkça buhar basıncı artar.
Buhar, aşağıdaki sıvı yüzeyi ile her zaman dengededir. Buhar formundaki moleküllerin sayısı, tek tek moleküllerin buhar veya sıvı formda bulunma olasılıklarına karar veren kinetik enerjisine bağlıdır.
Belirli bir sıvı için, sıcaklık artarsa, sıvıdaki moleküllerin kinetik enerjisi artar, bu da moleküllerin moleküller arası kuvvetlerin üstesinden gelmeye ve buhar halinde bulunmaya uygun hale gelmesini sağlar.
Buhar formundaki daha fazla molekül sayısı buhar basıncını arttırır. Suyun buhar basıncının sıcaklıkla tipik bir değişimi aşağıdaki resimde gösterilmektedir.

Kaynama Noktasını Etkileyen Faktörler
Kaynama noktasını etkileyen faktörler basınç, sıvıdaki safsızlıklar ve sıvı moleküller arası kuvvetlerdir.
Sistem basıncı daha yüksekse, sıvının buhar basıncını yükseltmek için daha fazla ısı gerekecektir.sistem basıncını elde edin. Kaynama noktasının su için dış basınç üzerindeki etkisi aşağıdaki eğri ile gösterilmektedir.

Saf bir çözücü ile safsızlıkları olan aynı çözünen maddeyi düşünürsek, saf çözücünün kaynama noktası her zaman daha düşüktür. Bunun nedeni, buhar sıvı arayüzündeki bazı bölgelerin işgal edildiği safsızlıklarla çözünen maddeye kıyasla, buhar için sıvı halden kaçmak için saf bir çözücü için daha fazla yüzey alanı mevcut olmasıdır.
Moleküller arası kuvvetleri daha yüksek olan daha büyük moleküllere sahip bir sıvının kaynama noktası daha yüksek olacaktır. Bunun nedeni, daha düşük moleküller arası kuvvetlere sahip daha küçük bileşen moleküllere sahip sıvıya kıyasla, belirli bir sıcaklıkta moleküller arası kuvvetleri yenerek sıvı yüzeyinin üzerinde daha az buharın serbest kalabilmesidir.
- Kazan Buhar Sıcaklığı İle İlgili 9 Gerçek: Çeşitli Tipler ve Detaylar
- Kazan Buhar Tamburu Hakkında 11 Gerçek: Ne, Nasıl, Malzeme, İşlev
- Kazan Bir Isıtma Sistemi midir: Yeni Başlayanların Bilmesi Gereken 7 Gerçek
- Kazan Kapalı Sistem mi yoksa Makine mi? Bilmeniz Gereken 5 Gerçek
- Kazan Enerjisi Verimli mi? Bilmeniz Gereken 7+ Gerçek
- Radyal Stres Üzerine 23 Gerçek: Eksiksiz Başlangıç Kılavuzu
Nasıl oluyor da basıncı değişen bir maddenin kaynama sıcaklığı değişiyor?
22,795 görüntülenme
Cevap Ver
- Soruyu Takip Et
- Raporla
- Mantık Hatası Bildir
Merhaba.Çok fazla soruyu bir arada sormuşsunuz ancak ben birkaç formül ile tüm sorularınızın cevaplarını aydınlığa kavuşturmak için yola çıktım,bir hatam olursa düzeltin lütfen.
P=Basınç
F=Kuvvet
m=Kütle
v=Hacim
d=Öz kütle
S=yüzey alanı
ŞİMDİ;
1)Formülden F'yi çekin F=P.S oldu.Yani kuvvet demek,basınç ile yüzey alanının çarpımı demek.
Devam edelim: Peki kuvvet formülü nedir?
Yine kuvvet demek kütle çarpı ivme demek.Buna göre m.a=P.S oldu.Bkz:Madde 1'den
Devam edelim: m kütle,burada amacımıza göre zekice bir şeyler yapmamız gerekiyor.Özkütle deneyelim.
m yi çekelim: d.v=m
Formülde yerine yazalım: oldu.Dünya'da olduğumuz için S(YÜZEY ALANI) sabit.Yine hacim ve ivme, şartlara göre sabit.Yerçekim ivmesi=9,8 her yerde yani.(Kutupları ignore edin şimdilik:)
Ne kaldı? d=P
Bir maddenin özkütlesi sıcaklığına bağlı olarak değişir. Sıcaklık artışı genellikle özkütleyi azaltır, ancak sıcaklığı arttıkça hacmi azalan ve özkütlesi artan maddeler de vardır. Olduğundan P'miz yani basınıcımız da bağlantılı olarak değişir.
5,988 görüntülenme